Pesquisa identifica substância natural envolvida na piora de reações inflamatórias
10/04/2015
Fernanda Turino / IOC
Compreender a resposta natural do organismo às inflamações, sejam elas de origem infecciosa ou crônico-degenerativa, pode ajudar na busca de novos tratamentos. Este é o tema do estudo que acaba de ser publicado por pesquisadores do Instituto Oswaldo Cruz (IOC/Fiocruz) na revista científica Nature Communications. Fruto de uma parceria entre Brasil e Alemanha, a pesquisa investigou o papel de um fosfolipídio bioativo chamado esfingosina-1-fosfato na piora da reação inflamatória. A descoberta pode ser a base para medidas que evitem este processo de agravamento, observado em doenças como artrite reumatoide, lúpus e pneumonias.
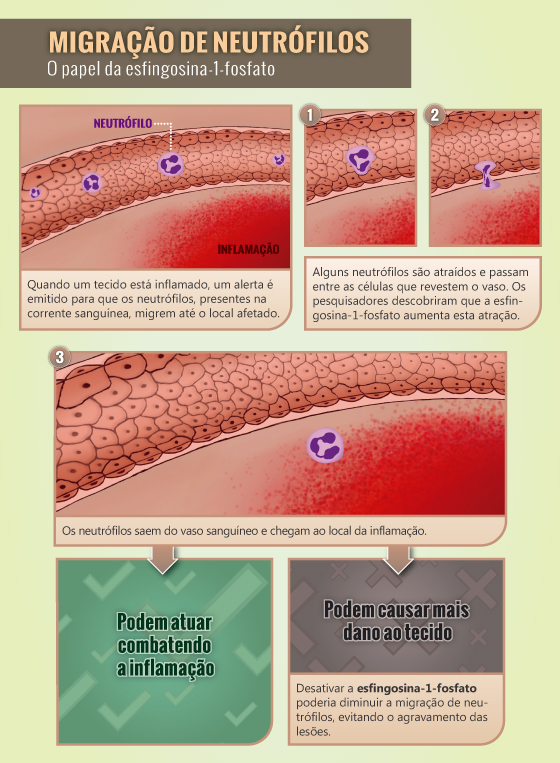
A esfingosina-1-fosfato atua no sistema imune e cardiovascular em um processo muito comum em inflamações agudas, o de migração de neutrófilos – células responsáveis pela defesa do organismo. “Esse é o processo pelo qual os neutrófilos saem da corrente sanguínea e migram para os tecidos onde ocorreu uma lesão ou inflamação e se acumulam neste local”, explica o pesquisador Hugo Caire, pesquisador do Laboratório de Imunofarmacologia do IOC/Fiocruz. Como resultado, duas situações antagônicas podem acontecer: os neutrófilos contribuem para a eliminação do agente agressor ou causam ainda mais dano no tecido. Impedir que o segundo caso ocorra é primordial para evitar que as inflamações possam contribuir para a deterioração do tecido.
Rolando sobre as células
Uma das etapas iniciais da resposta inflamatória acontece quando o organismo dispara um alerta que faz com que os neutrófilos presentes no sangue migrem até o tecido inflamado. Para isso, passam por um processo de adesão que envolve uma molécula chamada P-selectina que funciona como uma espécie de ímã unindo neutrófilos e células epiteliais, que revestem a parede dos vasos sanguíneos.
Uma vez junto da célula epitelial, o neutrófilo, que estava circulando livremente pelo sangue, passa por um processo de rolamento sobre as células, o que faz com que ele diminua sua velocidade até parar por completo. Em seguida, o neutrófilo passa por entre as células e sai do vaso sanguíneo, em direção ao tecido inflamado.
Diminuindo a atração
Durante o estudo, os pesquisadores perceberam que a esfigonsina-1-fosfato é capaz de intensificar a atração entre leucócitos e células epiteliais. Desativá-la diminuiria essa atração e, consequentemente, a migração e acúmulo de neutrófilos nas inflamações, o que pode ser positivo nos casos em que esse processo causa dano ao tecido afetado.
Encontrar formas de desativar a esfingosina-1-fosfato pode ser a chave para o desenvolvimento de novos fármacos que evitem o acúmulo nocivo de neutrófilos nos casos em que for nocivo. “De maneira geral, as infecções bacterianas são tipicamente patologias nas quais o influxo de neutrófilos para os tecidos afetados é uma característica marcante. Podemos citar como exemplo as pneumonias bacterianas”, exemplifica o pesquisador.
Animais geneticamente modificados
Para chegar aos dados que comprovam o papel da esfingosina-1-fosfato na resposta a inflamações, foram utilizados animais knockout, que são geneticamente modificados para que alguma característica de seu organismo seja modificada para favorecer a análise de aspectos específicos da sua fisiologia. No estudo foram utilizados animais geneticamente deficientes para o receptor da esfingosina-1-fosfato.
“Se o objetivo é investigar a possível interferência de uma molécula em determinado processo, pode-se usar um animal que tenha a molécula nocauteada, ou seja, não a apresente. A partir disso, é possível determinar se esta molécula interfere ou não no processo estudado”, explica Cassiano Albuquerque, aluno de pós-doutorado do Laboratório de Imunofarmacologia do IOC, que também assina o artigo.
Partidas e chegadas do estudo
A pesquisa partiu de uma proposta anterior: as pesquisas iniciais envolvendo pesquisadores alemães e brasileiros buscavam o desenvolvimento de um medicamento que bloqueasse a migração de neutrófilos em pacientes com artrite reumatóide.“Desta interação surgiu o interesse comum em tentar esclarecer com mais detalhes os mecanismos envolvidos no processo de migração de neutrófilos”, diz Hugo.
A descoberta serve como base para aplicações no futuro. “Alvos terapêuticos, baseados neste novo conhecimento podem originar estratégias visando controlar o influxo de neutrófilos naquelas situações nas quais ele podem causar maior dano ao tecido inflamado”, conclui Hugo Caire.
Mais na web